Promouvoir la mesure des émissions de composés organiques volatils (COV) par les différents compartiments de l’écosystème
Le service PTR-MS d’ANAEES est un service exploratoire qui a pour but de promouvoir la mesure des émissions de composés organiques volatils (COV) par les différents compartiments de l’écosystème (sol, plante, faune, micro-organismes). Nous cherchons à développer les méthodes permettant d’utiliser les profils de COV comme traceur du fonctionnement biologique des sols et de l’écosystème et de quantifier les échanges entre compartiments (les COV sont des transmetteurs) et avec l’atmosphère (polluants).
Trois types de méthodes de mesure des flux vont être développées dans le service :
(1) Des mesures dans des incubateurs sur des sols visant à identifier les profils de COV émis en fonction de la population microbienne et de sa fonction (dénitrifiantes par exemple).
(2) Des mesures sur site permettant de caractériser les émissions par les sols et les parties aériennes de l’écosystème à l’aide de méthodes de chambres, dans le but d’identifier les composés émis et absorbés par les différents compartiments de l’écosystème.
(3) Des mesures de flux total de l’écosystème à haute résolution temporelle permettant de caractériser les échanges à cette échelle.
Le choix du PTR-MS
Le PTR-MS a été commandé en 2014, suivant la procédure de marché public adéquat. Nous avons sélectionné le PTR-TOF-Qi-MS de Ionicon®. L’appareil a été livré le 5 mars et mis en ordre de marche le 24 mars avec le constructeur.
L’analyseur sélectionné est un spectromètre de masse (MS) à temps de vol (TOF) avec une source d’ionisation par transfert de proton (PTR) et un quad (Qi) utilisé comme guide d’ions pour améliorer la focalisation du faisceau d’ions dans le TOF. Cette dernière option est une nouveauté qui a permis de gagner un facteur 10 à 20 en sensibilité par rapport aux PTR-TOF-MS de génération précédente (sensibilité > 1000 coups par ppbv). L’analyseur fonctionne en flux continu : l’air est échantillonné entre 0.1 et 1 L min-1 et est analysé avec une fréquence allant jusqu’à 10 fois par secondes, permettant d’analyser rapidement des échantillons nombreux et permettant aussi la mesure des flux à l’échelle de la canopée par la méthode des covariances turbulentes (« Eddy Covariances », EC).
Une des difficultés du PTR-MS réside dans l’identification des molécules : la masse moléculaire uniquement ne donne pas accès à la molécule et ce d’autant plus que la masse moléculaire augmente car le nombre de combinaison augmente avec. Ce nouveau PTR-MS possède une très bonne résolution en masse qui devra faciliter l’identification : le rapport entre la masse et la largeur du pic à mi-hauteur est supérieur à 6000, pour des masses moléculaires supérieures à 79 g. Nous avons toutefois choisi deux options supplémentaires qui faciliteront cette identification : l’ionisation par NO+ et par O2+ qui sont des modes d’ionisation complémentaires du PTR (cassant plus ou moins les molécules, et ionisant des molécules qui ne sont pas ionisés avec les protons).Enfin un chromatographe en phase gazeuse rapide (fast-GC) sera ajouté en entrée du PTR-MS afin d’affiner cette identification.
Une vanne 16 voies a également été achetée en option pour permettre la multiplicité des mesures sur site (chambres, profils, EC, …) ou un scan multi-échantillons au laboratoire. Cette vanne est intégrée à l’instrument et peut être chauffée à 120°C
L’analyseur est relativement compact et ne consomme que 2.7 A en continu (4.5 A au démarrage). Un logiciel de contrôle et d’acquisition permet le contrôle en direct de toutes les options ainsi que des températures et débits d’échantillonnage. Tous ces paramètres sont aussi pilotables à distance via Labview.
L'équipe en charge du service
Une équipe s’est constituée à l’INRA ECOSYS pour assurer le développement des méthodes de mesure avec le PTR-Qi-TOF-MS.
- Céline Decuq et Florence Lafouge, ingénieures chimistes, se partagent le développement des protocoles et tests de l’instrument (paramètres optimaux d’utilisation, calibration, méthodes d’identification).
- Olivier Zurfluh, ingénieur informaticien, assure le développement des méthodes d’acquisition, de contrôle à distance et de traitement des données de l’instrument.
- Sophie Génermont, Carole Bedos et Benjamin Loubet, se chargent des développements et de la promotion scientifiques autour du service sur les thématiques des émissions de COV par les sols et les écosystèmes en particulier agricoles (apports de produits résiduaires organiques et de pesticides).
Cette équipe a suivi une formation de 2 jours à Ionicon® en Autriche pour bien maîtriser les fondamentaux et une formation pratique sur place lors de la mise en ordre de marche de l’instrument (formations comprises dans l’achat de l’instrument).
L’équipe prend actuellement en main l’instrument et teste toutes les fonctionnalités avant la fin de période d’admission de l’appareil qui aura lieu en septembre 2015 (validation définitive de l’achat). En parallèle les dispositifs d’échantillonnage (cellules, chambres, mesure ambiante) sont développés et la configuration de l’analyseur adaptée à chaque type d’échantillonnage (pression, tensions).
Les premières mesures avec le PTR-MS
Nous avons réalisé une série de tests sur des gaz de calibration qui nous ont permis de vérifier les caractéristiques de l’instrument et de tester concrètement la chaine de mesure et d’analyse: il ressort quelques éléments importants (potentiels, limites) pour l’utilisation future de l’instrument :
Un instrument facile d’utilisation
L’instrument est relativement facile d’utilisation : sa prise en main est relativement rapide, grâce à l’interface utilisateur bien pensée. Attention cela ne veut pas dire que la mesure est simple : une bonne mesure implique une connaissance approfondie des paramètres de l’instrument (pression, tensions) et des critères de fonctionnement. Une fois les protocoles de mesure et moyens d’échantillonnage et de contrôle définis par notre équipe, il nous paraît réalisable de laisser l’appareil en fonctionnement sur un site avec contrôle à distance.
Des performances excellentes
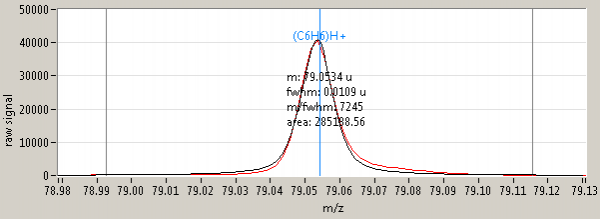
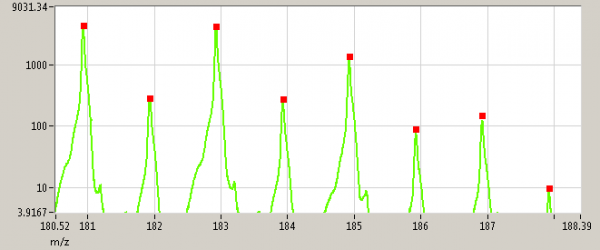
L’instrument possède une excellente résolution qui permet de discerner des pics distants de 0.01 g sans optimisation (Figure 1). L’instrument est également très sensible et linéaire sur plus de 5 ordres de grandeurs (Figure 2). Par ailleurs la calibration en masse est très précise, et une mesure à la masse 21.022 (isotope de l’eau protonnée) et 59.049 (acétone) suffit à étalonner toute la gamme à mieux que 0.0015. Le spectre est composé de 240 000 canaux et la mesure est réalisable en dehors des pics de H2O (19-20) et jusqu’à plus de 500 masses moléculaires.
Figure 1. Exemple de mesure du pic de masse du benzène protoné (C6H6)H+, de masse 79.05423 sur l’isotope principal. Mesure réalisée sur un gaz étalon Restek. La résolution du pic est de 7245. C’est le rapport entre la masse du pic 79.0534 et sa largeur à mi-hauteur. Cela veut dire que l’on peut discerner des pics distants de Dm = 79.0534 / 7245, soit 0.0109 g.
Figure 2. Exemple de mesure du massif isotopique du trichlorobenzène (C6H3 Cl3)H+. On distingue les 8 premiers isotopes sur presque trois ordre de grandeurs de coups par secondes (axe des ordonnées va de 10 à environ 4500). Cette mesure illustre à la fois la sensibilité et la linéarité de l’analyseur (le huitième isotope a une concentration de 8.8 pptv).
Des limites dont il faut être conscient
Deux limites principales sont à garder à l’esprit :
[1] la mesure du spectre de masse ne veut pas dire identification des formules chimiques des molécules. Ainsi à une masse moléculaire donnée avec une précision de 0.01 g, correspond d’une part plusieurs combinaisons de formules possibles et d’autre part des isomères (molécules aux propriétés chimiques différentes mais ayant des formules identiques). Ainsi le spectromètre de masse ne peut pas seul lever cette indétermination. C’est pourquoi nous allons commander un fast-GC qui permettra de séparer dans le temps les molécules de même formule mais aux propriétés chimiques différentes. De même en jouant sur la méthode d’ionisation il sera possible de casser plus ou moins les molécules en fonction de leurs propriétés chimiques et d’aider à l’identification. Cette phase nécessitera des comparaisons avec des chaines analytiques bien établies GC-MS, GC-MS-MS (disponibles dans notre laboratoire).
[2] La seconde limite tient à la quantification des concentrations de façon précise. En effet, deux éléments sont à garder en mémoire : d’une part le taux de protonation des molécules n‘est pas identique pour toutes les molécules ; il est constant dans une gamme de ± 30%. Sans calibration individualisée de chaque molécule la quantification reste donc dans cette marge d’incertitude. D’autre part, l’instrument possède une transmission faible des petites masses et fortes des masses plus élevées (liée à l’inertie des particules dans le guide d’ions). Ainsi par exemple la masse 21 est transmise à 1.8%, la masse 59 à 65% et pour les masses supérieures à 150, la transmission est de 100%.
Les prochaines étapes
- L’équipe va développer le service sur les 2 années à venir :
[1] développement de la méthodologie d’identification des composés,
[2] mise au point des systèmes de prélèvements (chambre, cellule, ambiant),
[3] mise au point des méthodes d’analyse des spectres et de quantification des molécules (calibration, ionisation O2+, NO+, GC),
[4] définition des protocoles et des coûts d’utilisation du service.
- Ce développement va s’appuyer sur :
[1] Un projet ADEME CORTEA (COV3ER) sur la mesure des échanges de COV par les différents compartiments de l’écosystème, basé sur des sites d’observation ANAEE et ICOS et qui couvre la période 2016-2018.
[2] Le recrutement d’un post-doctorat de 7 mois dans le cadre d’ANAEE, complémenté par 10 mois de supplémentaire financés par le projet COV3ER de 2016 à 2017.
[3] Une thèse à l’école doctorale des Sciences de l’environnement d’Île-de-France, co-encadrée avec Sophie BOURGETEAU-SADETd’AgroSup Dijon, sur le lien entre profils de COV émis et diversité génétique du sol.
[4] Une thèse de R2DS sur les émissions de COV par les grandes cultures.
[5] Deux dépôts de projet ADEME avec l’Ecotron de Montpellier (interaction GES, vers de terre) et AGroSup Dijon (effets des produits résiduaires organiques sur la qualité biologique des sols).
- Pendant cette phase de déploiement du service, nous sommes ouverts à des propositions de collaboration avec les membres du réseau ANAEE, dans la mesure de notre capacité d’analyse, dans cette phase de mise au point.